Ley de Boyle - Mariotte
La relación matemática que existe entre la presión y el volumen de un cantidad dad de un gas a una cierta temperatura fue descubierta por Robert Boyle en 1662. Boyle encerró una cantidad de aire en el extremo cerrado de un tubo en forma de U, utilizando mercurio como fluido de retención. Boyle descubrió que el producto de la presión por volumen de una cantidad fija de gas era un valor aproximadamente constante. Notó que si la presión de aire se duplica su volumen era la mitad del volumen anterior y si la presión se triplicaba el volumen bajaba a una tercera mitad del inicial. También observo que al calentar un gas aumentaba su volumen si la presión se mantenía constante, a este proceso se le llama proceso isoborico.
Cuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión: PV=K (Donde K es constante si la temperatura y la masa del gas permanecen constantes).
Cuando aumenta la presión, el volumen disminuye; si la presión disminuye el volumen aumenta. El valor exacto de la constante k , no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Ley de Avogadro
Es aquella en el que las constantes son presión y temperatura, siendo el Volumen directamente proporcional al Número de moles (n) matemáticamente, la fórmula es:
Ley de Charles
En 1787, Jacques Charles investigó la relación existente entre el volumen y la temperatura de un gas a presión constante. A una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura.
Al conservar la presión constante, el volumen aumenta y cuando la temperatura disminuye, el volumen también disminuye. Luego, había una proporcionalidad lineal directa entre el volumen y la temperatura, la cual se conoce como Ley de Charles.
Matemáticamente la expresión:
Ley de Gay-Lussac
Cuando se investiga experimentalmente como depende entre sí el volumen y la temperatura de un gas a una presión fija, se encuentra que el volumen aumenta linealmente al aumentar la temperatura.
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriar el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
Ley de las Presiones Parciales de Dalton:Ley de los gases ideales y Gases Reales
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y el comportamiento de mezclas gaseosas. A partir de sus mediciones dedujo que dos gases es una mezcla actuaban de manera mutuamente independiente.
Por ejemplo si se colocan tres gases en un recipiente de determinado volumen, V, se puede considerar que cada uno de los gases ocupa todo el volumen. Es decir, si el gas está cerrado, las moléculas del gas debido a su rápido movimiento azar y ase tamaño tan pequeño, ocuparán todo el recipiente. Luego, cada uno de los tres gases que forman todo el recipiente. Luego, cada uno de los tres gases forman la mezcla tendrá el volumen V. Ahora, si temperatura del recipiente tuviera un valor constante, T, cada uno de los gases tendría esta temperatura.
Si estudiamos cada uno de estos gases en forma separada, la contribución a la presión de cada componente está directamente relacionada con el número de moles del componente y con la razón a la que las partículas chocan con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y temperatura, las diferencias entre las presiones que ejercen se deberá a los distintos números de moles.
La presión que ejerce un componente determinado de la mezcla de gases si éste ocupara por sí solo el recipiente, se llama presión parcial del componente. Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial, Pc, para una componente consistente en no moles está dada por la expresión:
Se puede calcular la presión parcial de cada componente, si se conoce el número de moles de cada uno en la mezcla encerrada en un volumen determinado, a una temperatura dada. Debido a que las partículas de cada gas componente se conducen en forma independiente, la presión total que ejerza la mezcla será un resultado de todas las partículas.
Establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Pt = pa + pb + pc + ...
Está relación se conoce como Ley de las Presiones Parciales de Dalton e indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los componentes de la mezcla.
La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases
A partir de los postulados de la teoría cinética se dedujo la ley de los gases ideales o ecuación de estado, PV = nRT, pero no existe un gas real cuyo comportamiento se ajuste completamente a esta ecuación. No obstante la mayoría de los cálculos relativos a los gases puede hacerse, con suficiente precisión, mediante esta ley.Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
Por otra parte, la ecuación de estado, las leyes de Boyle, Charles y Avogadro se establecieron con base en un modelo de gas ideal, y los gases reales se desvían de este comportamiento tanto más cuanto más alta sea la presión y más baja la temperatura.
Un gas ideal es el que se ajusta estrictamente a las leyes de los gases y posee todas las propiedades dadas por la teoría cinética.
Según la teoría cinética, en un gas ideal no existe fuerza de atracción entre las moléculas, ni estas ocupan espacio.
Un gas real difiere de un gas ideal en que sus moléculas tienen un volumen definido y se atraen entre sí.
Precisamente el valor práctico de la teoría cinética estriba en que muchos gases reales tienen comportamiento muy aproximado a gases ideales.
Siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
R = 1,987 cal·K−1·mol−1
R = 8,31451 10−10 erg ·K−1·mol−1
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. También se le llama la ecuación de estado de los gases; ya que solo depende del estado actual en que se encuentre el gas.
Suscribirse a:
Enviar comentarios (Atom)






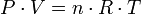

No hay comentarios:
Publicar un comentario