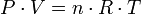Gas natural
Producción de gas natural según país.El gas natural es una fuente de energía no renovable formada por una mezcla de gases ligeros que se encuentra frecuentemente en yacimientos de petróleo, disuelto o asociado con el petróleo o en depósitos de carbón. Aunque su composición varía en función del yacimiento del que se saca, está compuesto principalmente por metano en cantidades que comúnmente pueden superar el 90 ó 95% (p. ej., el gas no-asociado del pozo West Sole en el Mar del Norte), y suele contener otros gases como nitrógeno, CO2, H2S, helio y mercaptanos. Como ejemplo de contaminantes cabe mencionar el gas no-asociado de Kapuni (NZ) que contiene hasta 49% de CO2. Como fuentes adicionales de este recurso natural, se están investigando los yacimientos de hidratos de metano que, según estimaciones, pueden suponer una reserva energética muy superiores a las actuales de gas natural.
Puede obtenerse también con procesos de descomposición de restos orgánicos (basuras, vegetales - gas de pantanos) en las plantas de tratamiento de estos restos (depuradoras de aguas residuales urbanas, plantas de procesado de basuras, de alpechines, etc.). El gas obtenido así se llama biogás.
Algunos de los gases que forman parte del gas natural extraído se separan de la mezcla porque no tienen capacidad energética (nitrógeno o CO2) o porque pueden depositarse en las tuberías usadas para su distribución debido a su alto punto de ebullición. Si el gas fuese criogénicamente licuado para su almacenamiento, el dióxido de carbono (CO2) solidificaría interfiriendo con el proceso criogénico. El CO2 puede ser determinado por los procedimientos ASTM D 1137 o ASTM D 1945. El propano, butano e hidrocarburos más pesados en comparación con el gas natural son extraídos, puesto que su presencia puede causar accidentes durante la combustión del gas natural. El vapor de agua también se elimina por estos motivos y porque a temperaturas cercanas a la temperatura ambiente y presiones altas forma hidratos de metano que pueden obstruir los gasoductos. Los compuestos de azufre son eliminados hasta niveles muy bajos para evitar corrosión y olores perniciosos, así como para reducir las emisiones de compuestos causantes de lluvia ácida. La detección y la medición de H2S se puede realizar con los métodos ASTM D2385 o ASTM D 2725. Para uso doméstico, al igual que al butano, se le añaden trazas de compuestos de la familia de los mercaptano entre ellos el metil-mercaptano, para que sea fácil detectar una fuga de gas y evitar su ignición espontánea.
El gas natural produce mucho menos CO2 que otros combustibles como los derivados del petróleo, y sobre todo el carbón. Además es un combustible que se quema más limpia y eficazmente.
La razón por la cual produce poco CO2 es que el principal componente, metano, contiene cuatro átomos de hidrógeno y uno de carbono, produciendo 2 moléculas de agua por cada una de CO2, mientras que los hidrocarburos de cadena larga (líquidos) producen sólo 1 molécula de agua por cada 1 de CO2 (recordemos que el calor de formación del agua es muy alto).
Como ventaja añadida es un combustible más versátil, que puede utilizar en sistemas de generación más eficientes como el ciclo combinado o la pila de combustible y su obtención es más sencilla en comparación con otros combustibles. Sin embargo, su contenido energético por unidad de volumen es bajo en comparación con otros combustibles.
El 87% de todas las formas de energía que usamos corresponde a hidrocarburos. El carbón, junto al petróleo genera 64%, el gas genera el 23% (equivalente a unos 50 millones de barriles de petróleo al día). Un 12% es generado con hidroeléctricas y plantas nucleares. Todas las demás formas de energía --eólica, solar, geotérmica, etc.-- representan solo el 1%. El gas natural es un hidrocarburo fósil atrapado bajo la tierra en depósitos que alcanzan enormes dimensiones. Como todo hidrocarburo, el gas natural, compuesto de carbono e hidrógeno, es un combustible con alto contenido de energía.
El gas natural puede ser empleado para producir hidrógeno que se puede utilizar en los vehículos de hidrógeno.
1 Nm3 (Normal metro cúbico,metro cúbico en condiciones normales, 20 °C de temperatura y 1 atmósfera de presión) de gas natural produce aproximadamente 10,4 kWh.
-El CO2 y los otros más hidrocarburos; etano, propano, butano.. expulsado a la atmósfera por el gas producen una reacción solar menos energética. Esto, pues produce que la tierra se vea afectada por un incremento de 0,2-0,5 °C cada década ya que los rayos del sol inciden en la atmósfera pero una parte de ellos no sale y se refleja a la tierra.
Gas combustible
Un gas combustible es un gas que se utiliza como combustible para producir energía térmica mediante un proceso de combustión.
El gas natural (cuyo mayor componente es el metano) es el más habitual, pero existen otros como:
Gas licuado del petróleo (GLP), como propano o butano.
Se obtienen mayoritariamente en la destilación fraccionada del petróleo. Otra parte es obtenida al separarlos del gas natural.
Hidrógeno.
Se obtiene a partir de la electrólisis del agua invirtiendo energía eléctrica, o a partir de gas natural.
Es un vector energético y no una fuente de energía primaria. Puede llegar a ser utilizado en el futuro como gas combustible con una mejora de la tecnología.
Gas de alumbrado (H2 y CO2), también conocido como gas de hulla o gas ciudad.
Gas de agua (H2 y CO).
Propiedades de Los Gases
La mayoría de los gases son incoloros, como el O2 y el H2. Otros como el F y el Cl son amarillos verdosos; el Br, el NO2 y el N2O3 son café rojizos; el L es violeta. Hay gases ácidos, alcalinos y neutros. Pueden ser elementos como el O2 y el H2 o compuestos como el CO2 y el SO2.
En comparación con los otros estados de la materia, los gases se difunden rápidamente por su elevada energía cinética. Además, se expanden bastante al calentarlos. Al ejercer sobre ellos una presión, disminuyen su volumen. Para explicar el comportamiento de un gas se tiene en cuenta el volumen, la presión, la temperatura y la cantidad.
Volumen
El volumen de un gas corresponde al volumen del recipiente q lo contiene…
Si hay O2 gaseoso en un recipiente cerrado cuyo volumen es de 2 litros, el volumen del O2 es también de 2 litros, y si se pasa a un recipiente cuyo volumen es de 3 litros, el O2 tendrá un volumen de 3 litros. Además, cuando se mezclan 2 o más gases, cada uno ocupa el recipiente como si estuviera solo.
Cuando se miden volúmenes de gases es necesario tener en cuenta la presión y la temperatura.
Temperatura
La temperatura es el grado de intensidad de calor: se expresa al realizar cálculos con los gases en la escala de temperatura Kelvin o escala absoluta:
K°= °C + 273
Presión
La presión de un gas es la fuerza ejercida por sus moléculas cuando chocan contra las paredes del recipiente que las contiene…
Los gases de la atmosfera ejercen presión sobre la superficie terrestre. Esta presión se llama presión atmosférica.
1atm = 76cm Hg = 760mm Hg = 760Torr
Como la presión es la fuerza por unidad de área, se expresa en Kg fuerza/cm², libras fuerza/pulg² o dinas/cm².
Cantidad de un gas
La cantidad de un gas se expresa en moles (n); ya que esta unidad es fácil obtenerla a partir de gramos o de número de moléculas de un compuesto.
Cuando se habla de condiciones normales (C.N) en un gas, significa que la temperatura es de 0°C o 273°K y la presión es de 1 atm o 760 Torr.
En comparación con los otros estados de la materia, los gases se difunden rápidamente por su elevada energía cinética. Además, se expanden bastante al calentarlos. Al ejercer sobre ellos una presión, disminuyen su volumen. Para explicar el comportamiento de un gas se tiene en cuenta el volumen, la presión, la temperatura y la cantidad.
Volumen
El volumen de un gas corresponde al volumen del recipiente q lo contiene…
Si hay O2 gaseoso en un recipiente cerrado cuyo volumen es de 2 litros, el volumen del O2 es también de 2 litros, y si se pasa a un recipiente cuyo volumen es de 3 litros, el O2 tendrá un volumen de 3 litros. Además, cuando se mezclan 2 o más gases, cada uno ocupa el recipiente como si estuviera solo.
Cuando se miden volúmenes de gases es necesario tener en cuenta la presión y la temperatura.
Temperatura
La temperatura es el grado de intensidad de calor: se expresa al realizar cálculos con los gases en la escala de temperatura Kelvin o escala absoluta:
K°= °C + 273
Presión
La presión de un gas es la fuerza ejercida por sus moléculas cuando chocan contra las paredes del recipiente que las contiene…
Los gases de la atmosfera ejercen presión sobre la superficie terrestre. Esta presión se llama presión atmosférica.
1atm = 76cm Hg = 760mm Hg = 760Torr
Como la presión es la fuerza por unidad de área, se expresa en Kg fuerza/cm², libras fuerza/pulg² o dinas/cm².
Cantidad de un gas
La cantidad de un gas se expresa en moles (n); ya que esta unidad es fácil obtenerla a partir de gramos o de número de moléculas de un compuesto.
Cuando se habla de condiciones normales (C.N) en un gas, significa que la temperatura es de 0°C o 273°K y la presión es de 1 atm o 760 Torr.
Leyes de Los Gases
Ley de Boyle - Mariotte
La relación matemática que existe entre la presión y el volumen de un cantidad dad de un gas a una cierta temperatura fue descubierta por Robert Boyle en 1662. Boyle encerró una cantidad de aire en el extremo cerrado de un tubo en forma de U, utilizando mercurio como fluido de retención. Boyle descubrió que el producto de la presión por volumen de una cantidad fija de gas era un valor aproximadamente constante. Notó que si la presión de aire se duplica su volumen era la mitad del volumen anterior y si la presión se triplicaba el volumen bajaba a una tercera mitad del inicial. También observo que al calentar un gas aumentaba su volumen si la presión se mantenía constante, a este proceso se le llama proceso isoborico.
Cuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión: PV=K (Donde K es constante si la temperatura y la masa del gas permanecen constantes).
Cuando aumenta la presión, el volumen disminuye; si la presión disminuye el volumen aumenta. El valor exacto de la constante k , no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Ley de Avogadro
Es aquella en el que las constantes son presión y temperatura, siendo el Volumen directamente proporcional al Número de moles (n) matemáticamente, la fórmula es:
Ley de Charles
En 1787, Jacques Charles investigó la relación existente entre el volumen y la temperatura de un gas a presión constante. A una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura.
Al conservar la presión constante, el volumen aumenta y cuando la temperatura disminuye, el volumen también disminuye. Luego, había una proporcionalidad lineal directa entre el volumen y la temperatura, la cual se conoce como Ley de Charles.
Matemáticamente la expresión:
Ley de Gay-Lussac
Cuando se investiga experimentalmente como depende entre sí el volumen y la temperatura de un gas a una presión fija, se encuentra que el volumen aumenta linealmente al aumentar la temperatura.
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriar el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
Ley de las Presiones Parciales de Dalton:Ley de los gases ideales y Gases Reales
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y el comportamiento de mezclas gaseosas. A partir de sus mediciones dedujo que dos gases es una mezcla actuaban de manera mutuamente independiente.
Por ejemplo si se colocan tres gases en un recipiente de determinado volumen, V, se puede considerar que cada uno de los gases ocupa todo el volumen. Es decir, si el gas está cerrado, las moléculas del gas debido a su rápido movimiento azar y ase tamaño tan pequeño, ocuparán todo el recipiente. Luego, cada uno de los tres gases que forman todo el recipiente. Luego, cada uno de los tres gases forman la mezcla tendrá el volumen V. Ahora, si temperatura del recipiente tuviera un valor constante, T, cada uno de los gases tendría esta temperatura.
Si estudiamos cada uno de estos gases en forma separada, la contribución a la presión de cada componente está directamente relacionada con el número de moles del componente y con la razón a la que las partículas chocan con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y temperatura, las diferencias entre las presiones que ejercen se deberá a los distintos números de moles.
La presión que ejerce un componente determinado de la mezcla de gases si éste ocupara por sí solo el recipiente, se llama presión parcial del componente. Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial, Pc, para una componente consistente en no moles está dada por la expresión:
Se puede calcular la presión parcial de cada componente, si se conoce el número de moles de cada uno en la mezcla encerrada en un volumen determinado, a una temperatura dada. Debido a que las partículas de cada gas componente se conducen en forma independiente, la presión total que ejerza la mezcla será un resultado de todas las partículas.
Establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Pt = pa + pb + pc + ...
Está relación se conoce como Ley de las Presiones Parciales de Dalton e indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los componentes de la mezcla.
La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases
A partir de los postulados de la teoría cinética se dedujo la ley de los gases ideales o ecuación de estado, PV = nRT, pero no existe un gas real cuyo comportamiento se ajuste completamente a esta ecuación. No obstante la mayoría de los cálculos relativos a los gases puede hacerse, con suficiente precisión, mediante esta ley.Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
Por otra parte, la ecuación de estado, las leyes de Boyle, Charles y Avogadro se establecieron con base en un modelo de gas ideal, y los gases reales se desvían de este comportamiento tanto más cuanto más alta sea la presión y más baja la temperatura.
Un gas ideal es el que se ajusta estrictamente a las leyes de los gases y posee todas las propiedades dadas por la teoría cinética.
Según la teoría cinética, en un gas ideal no existe fuerza de atracción entre las moléculas, ni estas ocupan espacio.
Un gas real difiere de un gas ideal en que sus moléculas tienen un volumen definido y se atraen entre sí.
Precisamente el valor práctico de la teoría cinética estriba en que muchos gases reales tienen comportamiento muy aproximado a gases ideales.
Siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
R = 1,987 cal·K−1·mol−1
R = 8,31451 10−10 erg ·K−1·mol−1
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. También se le llama la ecuación de estado de los gases; ya que solo depende del estado actual en que se encuentre el gas.
La relación matemática que existe entre la presión y el volumen de un cantidad dad de un gas a una cierta temperatura fue descubierta por Robert Boyle en 1662. Boyle encerró una cantidad de aire en el extremo cerrado de un tubo en forma de U, utilizando mercurio como fluido de retención. Boyle descubrió que el producto de la presión por volumen de una cantidad fija de gas era un valor aproximadamente constante. Notó que si la presión de aire se duplica su volumen era la mitad del volumen anterior y si la presión se triplicaba el volumen bajaba a una tercera mitad del inicial. También observo que al calentar un gas aumentaba su volumen si la presión se mantenía constante, a este proceso se le llama proceso isoborico.
Cuando el volumen y la presión de una cierta cantidad de gas es mantenida a temperatura constante, el volumen será inversamente proporcional a la presión: PV=K (Donde K es constante si la temperatura y la masa del gas permanecen constantes).
Cuando aumenta la presión, el volumen disminuye; si la presión disminuye el volumen aumenta. El valor exacto de la constante k , no es necesario conocerlo para poder hacer uso de la Ley; si consideramos las dos situaciones, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Ley de Avogadro
Es aquella en el que las constantes son presión y temperatura, siendo el Volumen directamente proporcional al Número de moles (n) matemáticamente, la fórmula es:
Ley de Charles
En 1787, Jacques Charles investigó la relación existente entre el volumen y la temperatura de un gas a presión constante. A una presión dada, el volumen ocupado por un gas es directamente proporcional a su temperatura.
Al conservar la presión constante, el volumen aumenta y cuando la temperatura disminuye, el volumen también disminuye. Luego, había una proporcionalidad lineal directa entre el volumen y la temperatura, la cual se conoce como Ley de Charles.
Matemáticamente la expresión:
Ley de Gay-Lussac
Cuando se investiga experimentalmente como depende entre sí el volumen y la temperatura de un gas a una presión fija, se encuentra que el volumen aumenta linealmente al aumentar la temperatura.
La presión del gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Es por esto que para poder envasar gas, como gas licuado, primero se ha de enfriar el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
Ley de las Presiones Parciales de Dalton:Ley de los gases ideales y Gases Reales
Cuando Dalton formuló por primera vez su teoría atómica poco había elaborado la teoría acerca de la vaporización del agua y el comportamiento de mezclas gaseosas. A partir de sus mediciones dedujo que dos gases es una mezcla actuaban de manera mutuamente independiente.
Por ejemplo si se colocan tres gases en un recipiente de determinado volumen, V, se puede considerar que cada uno de los gases ocupa todo el volumen. Es decir, si el gas está cerrado, las moléculas del gas debido a su rápido movimiento azar y ase tamaño tan pequeño, ocuparán todo el recipiente. Luego, cada uno de los tres gases que forman todo el recipiente. Luego, cada uno de los tres gases forman la mezcla tendrá el volumen V. Ahora, si temperatura del recipiente tuviera un valor constante, T, cada uno de los gases tendría esta temperatura.
Si estudiamos cada uno de estos gases en forma separada, la contribución a la presión de cada componente está directamente relacionada con el número de moles del componente y con la razón a la que las partículas chocan con las paredes del recipiente. Dado que cada componente tiene el mismo volumen y temperatura, las diferencias entre las presiones que ejercen se deberá a los distintos números de moles.
La presión que ejerce un componente determinado de la mezcla de gases si éste ocupara por sí solo el recipiente, se llama presión parcial del componente. Las presiones parciales se calculan aplicando la ley de los gases ideales a cada componente. Así la presión parcial, Pc, para una componente consistente en no moles está dada por la expresión:
Se puede calcular la presión parcial de cada componente, si se conoce el número de moles de cada uno en la mezcla encerrada en un volumen determinado, a una temperatura dada. Debido a que las partículas de cada gas componente se conducen en forma independiente, la presión total que ejerza la mezcla será un resultado de todas las partículas.
Establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Pt = pa + pb + pc + ...
Está relación se conoce como Ley de las Presiones Parciales de Dalton e indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de los componentes de la mezcla.
La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla de gases
A partir de los postulados de la teoría cinética se dedujo la ley de los gases ideales o ecuación de estado, PV = nRT, pero no existe un gas real cuyo comportamiento se ajuste completamente a esta ecuación. No obstante la mayoría de los cálculos relativos a los gases puede hacerse, con suficiente precisión, mediante esta ley.Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
Por otra parte, la ecuación de estado, las leyes de Boyle, Charles y Avogadro se establecieron con base en un modelo de gas ideal, y los gases reales se desvían de este comportamiento tanto más cuanto más alta sea la presión y más baja la temperatura.
Un gas ideal es el que se ajusta estrictamente a las leyes de los gases y posee todas las propiedades dadas por la teoría cinética.
Según la teoría cinética, en un gas ideal no existe fuerza de atracción entre las moléculas, ni estas ocupan espacio.
Un gas real difiere de un gas ideal en que sus moléculas tienen un volumen definido y se atraen entre sí.
Precisamente el valor práctico de la teoría cinética estriba en que muchos gases reales tienen comportamiento muy aproximado a gases ideales.
Siendo P la presión, V el volumen, n el número de moles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
R = 1,987 cal·K−1·mol−1
R = 8,31451 10−10 erg ·K−1·mol−1
De esta ley se deduce que un mol de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmósfera. También se le llama la ecuación de estado de los gases; ya que solo depende del estado actual en que se encuentre el gas.
Cambio de Estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en nuestro universo es el plasma, material del que están compuestas las estrellas (si descartamos la materia oscura).
La fusión es el cambio de estado de sólido a líquido.
Por el contrario la solidificación o congelación es el cambio inverso, de líquido a sólido.
La vaporización es el cambio de estado de líquido a gas.
Contrariamente la licuación o condensación es el cambio inverso, de gas a líquido.
La sublimación es el cambio de estado de sólido a gas.
El cambio inverso recibe el nombre de sublimación regresiva o cristalización.
La ionización es el cambio de estado de un gas a plasma.
En caso contrario, se le llama deionización.
La fusión es el cambio de estado de sólido a líquido.
Por el contrario la solidificación o congelación es el cambio inverso, de líquido a sólido.
La vaporización es el cambio de estado de líquido a gas.
Contrariamente la licuación o condensación es el cambio inverso, de gas a líquido.
La sublimación es el cambio de estado de sólido a gas.
El cambio inverso recibe el nombre de sublimación regresiva o cristalización.
La ionización es el cambio de estado de un gas a plasma.
En caso contrario, se le llama deionización.
Usos de Los Gases Nobles
Hoy en día se utiliza helio líquido para refrigerar los imanes superconductores en los escáneres de resonancia magnética.Los gases nobles tienen un punto de ebullición y de fusión muy bajos, lo que los hace útiles como refrigerantes criogénicos.
En particular, el helio líquido, que hierve a 4,2 K, se utiliza para imanes superconductores, como los que se emplean para la imagen por resonancia magnética y la resonancia magnética nuclear.
El neón líquido, aunque no llega a temperaturas tan bajas como el helio líquido, también tiene aplicaciones en la criogenia, pues tiene una capacidad de refrigeración más de 40 veces superior a la del helio líquido y más de tres veces superior a la del hidrógeno líquido.
El helio se utiliza como componente de los gases respirables para sustituir al nitrógeno, gracias a su baja solubilidad en fluidos, especialmente en lípidos. Los gases son absorbidos por la sangre y los tejidos corporales cuando hay presión, como en el submarinismo, lo que provoca un efecto anestésico conocido como "mal de profundidad". Debido a su baja solubilidad, entra poco helio en las membranas celulares, y cuando se utiliza helio para sustituir parte de los gases respirables, como en el trimix o el heliox, se consigue una reducción del efecto narcótico del gas en profundidad. La baja solubilidad del helio ofrece más ventajas para el trastorno conocido como enfermedad por descompresión. A menor cantidad de gas disuelto en el cuerpo significa que se forman menos burbujas de gas durante la reducción de la presión durante el ascenso. Otro gas noble, el argón, es considerado la mejor opción como gas de inflación del traje seco en el submarinismo.
Desde el desastre del Hindenburg de 1937,el helio ha sustituido al hidrógeno como gas de sustentación en los dirigibles y globos, gracias a su ligereza e incombustibilidad, pese a una reducción en la flotabilidad de un 8,6%. En muchas aplicaciones, los gases nobles se utilizan para formar una atmósfera inerte. El argón se utiliza en la síntesis de compuestos sensibles al aire que al mismo tiempo, son sensibles al nitrógeno.
El argón sólido también se utiliza para estudiar compuestos muy estables, como intermedios reactivos, atrapándolos en una matriz inerte a temperaturas muy bajas.
El helio es utilizado como medio portador en la cromatografía de gases, como gas de relleno en los termómetros, y en aparatos para medir la radiación, como el contador Geiger y la cámara de burbujas. Tanto el helio como el argón se utilizan habitualmente para proteger arcos de soldadura y metal base que les rodea de la atmósfera durante la soldadura y la ablación, así como en otros procesos metalúrgicos y la producción de silicio para la industria de los semiconductores.
Los gases nobles se usan habitualmente para la iluminación debido a su falta de reactividad química. El argón, mezclado con nitrógeno, se utiliza como gas de relleno de las bombillas incandescentes.
El kriptón se usa en bombillas de alto rendimiento, que tienen una temperatura de color más elevada y una mayor eficacia, pues reduce la velocidad de evaporación del filamento más que el argón, las lámparas de halógeno, en particular, utilizan kriptón mezclado con pequeñas cantidades de compuestos de yodo o bromo.
Los gases nobles lucen con colores característicos cuando se les utiliza en lámparas de descarga, como los faros de neón, que producen un color naranja-rojo. El xenón es utilizado habitualmente en faros de xenón que, debido a su espectro casi continuo que se asemeja a la luz del día, se usan en proyectores de películas y como faros de automóvil.
Los gases nobles se usan en láseres de excímeros, que se basan en moléculas excitadas electrónicamente de vida corta conocidas como excímeros. Los excímeros utilizados en los láseres pueden ser dímeros de gases nobles como Ar 2, Kr 2 o Xe 2, o más habitualmente, el gas noble es combinado con un halógeno en excímeros como ArF, KrF, XeF o XeCl. Estos láseres producen una luz ultravioleta que, debido a su longitud de onda corta (193 nm por ArF y 248 nm para KrF), permite una imagen de alta precisión. Los láseres de excímeros tienen muchos usos industriales, médicos y científicos. Se utilizan en la microlitografía y la microfabricación, esenciales para la manufactura de circuitos integrados y por cirugía láser, incluyendo la angioplastia láser y la cirugía ocular.
Algunos gases nobles tienen un uso directo en la medicina. A veces se usa el helio para mejorar la facilidad de respiración de los pacientes con asma.
El xenón se utiliza como anestésico debido a su alta solubilidad en lípidos, que lo hace más potente que el habitual óxido nitroso, y como es eliminado fácilmente por el cuerpo, permite un restablecimiento más rápido.
La captación de imágenes hechas a través de la resonancia magnética utiliza el xenón en combinación con otros gases. El radón, que es muy radiactivo y sólo está disponible en cantidad mínimas, sirve en el tratamiento por radioterapia.
Gas noble
Son un grupo de elementos químicos con propiedades muy similares: bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 (8A) de la tabla periódica (anteriormente llamado grupo 0). Los seis gases nobles que se encuentran en la naturaleza son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe) y el radioactivo radón (Rn). Hasta ahora el siguiente miembro del grupo, el ununoctio (Uuo), ha sido sintetizado en un acelerador de partículas, pero se conoce muy poco de sus propiedades debido a la pequeña cantidad producida y su corta vida media.
Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su capa electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas, por lo que sólo unos pocos compuestos de gases nobles han sido preparados hasta 2008. El xenón reacciona de manera espontánea con el flúor (debido a la alta electronegatividad de éste), y a partir de los compuestos resultantes se han alcanzado otros. También se han aislado algunos compuestos con kriptón. Los puntos de fusión y de ebullición de cada gas noble están muy próximos, difiriendo en menos de 10 °C; consecuentemente, sólo son líquidos en un rango muy pequeño de temperaturas.
El neón, argón, kriptón y xenón se obtienen del aire usando los métodos de licuefacción y destilación fraccionada. El helio es típicamente separado del gas natural y el radón se aísla normalmente a partir del decaimiento radioactivo de compuestos disueltos del radio. Los gases nobles tienen muchas aplicaciones importantes en industrias como iluminación, soldadura y exploración espacial. La combinación helio-oxígeno-nitrógeno (trimix) se emplea para respirar en inmersiones de profundidad para evitar que los buzos sufran el efecto narcótico del nitrógeno. Después de verse los riesgos causados por la inflamabilidad del hidrógeno, éste fue reemplazado por helio en los dirigibles y globos aerostáticos.
Propiedades físicas y atómicas
Número atómico 2 10 18 36 54 86
Nombre del elemento Helio Neón Argón Kriptón Xenón Radón
Densidad (kg/m3) 0,1785 0,9002 1,7818 3,708 5,851 9,970
Radio atómico (nm) 0,050 0,070 0,094 0,109 0,130 —
Punto de ebullición (°C) –268,83 –245,92 –185,81 –151,70 –106,60 –62
Punto de fusión (°C) –272 –248,52 –189,6 –157 –111,5 –71
Los gases nobles cuentan con fuerzas intermoleculares muy débiles y, por lo tanto, tienen puntos de fusión y de ebullición muy bajos. Todos ellos son gases monoatómicos bajo condiciones estándar, incluyendo aquellos que tienen masas atómicas mayores que algunos elementos que se encuentran normalmente en estado sólido. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que presenta superfluidez; de la misma manera no puede ser solidificado por enfriamiento bajo condiciones estándar, sino que se convierte en sólido bajo una presión de 25 atm (2500 kPa; 370 psi) y 0,95 K (−272,20 °C; −457.960 °F).
Los gases nobles hasta el xenón tienen múltiples isótopos estables. El radón no tiene isótopos estables; su isótopo de mayor duración tiene un periodo de semidesintegración de 3,8 días que puede formar helio y polonio.
El radio atómico de los gases nobles aumenta de un periodo a otro debido al incremento en el número de electrones. El tamaño del átomo se relaciona con varias propiedades. Por ejemplo, el potencial de ionización disminuye a medida que aumenta el radio ya que los electrones de valencia en los átomos más grandes se encuentran más alejados del núcleo y, por lo tanto, no se encuentran ligados tan fuertemente por el átomo. Los gases nobles tienen los mayores potenciales de ionización de cada periodo, lo cual refleja lo estable que es su configuración electrónica y genera su falta de reactividad química. Sin embargo, algunos de los gases nobles más pesados tienen potenciales de ionización lo suficientemente bajos para ser comparables a los de otros elementos y moléculas. El químico Neil Bartlett, intentando crear el compuesto de un gas noble, notó que el potencial de ionización del xenón era similar al de la molécula de oxígeno, por lo que intentó oxidar xenón usando hexafluoruro de platino, un agente oxidante tan fuerte que es capaz de reaccionar con oxígeno.
Los gases nobles no pueden aceptar un electrón para formar aniones estables. Esto quiere decir que poseen una afinidad electrónica negativa.
Gráfico de potencial de ionización respecto al número atómico. Los gases nobles tienen el mayor potencial de ionización de cada periodo.Las propiedades físicas macroscópicas de los gases nobles están determinadas por las débiles fuerzas de Van der Waals que se dan entre átomos. Las fuerzas de atracción aumentan con el tamaño del átomo como un resultado del incremento en la polarizabilidad y el descenso del potencial de ionización. Esto lleva a tendencias grupales sistemáticas. Por ejemplo, a medida que se baja en los grupos de la tabla periódica, el radio atómico y las fuerzas interatómicas aumentan. De igual forma, se adquieren mayores puntos de fusión y de ebullición, entalpía de vaporización y solubilidad. El aumento en densidad se debe al incremento en masa atómica.
Los gases nobles se comportan como gases ideales bajo condiciones normales de presión y temperatura, pero sus tendencias anormales a la ley de los gases ideales proporcionan claves importantes para el estudio de las fuerzas e interacciones moleculares. El potencial de Lennard-Jones, usado frecuentemente para modelar fuerzas intermoleculares, fue deducido en 1924 por John Lennard-Jones a partir de datos experimentales del argón antes de que el desarrollo de la mecánica cuántica proporcionara las herramientas necesarias para entender las fuerzas intermoleculares a partir de primeros principios.
El análisis teórico de estas fuerzas se volvió viable debido a que los gases nobles son monoatómicos, y por tanto isótropos (independientes de la dirección).
Propiedades químicas
Tabla de gases con respectivas capas de electrones Z Elemento
Electrones por capa
2 helio 2
10 neón 2, 8
18 argón 2, 8, 8
36 kriptón 2, 8, 18, 8
54 xenón 2, 8, 18, 18, 8
86 radón 2, 8, 18, 32, 18, 8
118 ununoctio 2, 8, 18, 32, 32, 18, 8
En los seis primeros periodos de la tabla periódica, los gases nobles son exactamente los miembros del grupo 18 (8A) de la tabla (anteriormente conocido como grupo 0). Sin embargo, esto ya no es cierto en el séptimo periodo (debido a efectos relativistas): el siguiente miembro del grupo 18, el ununoctio, probablemente no es un gas noble.
En cambio, el miembro del grupo 14 Ununquadio presenta propiedades similares a las de los gases nobles.
Los gases nobles son incoloros, inodoros, insípidos y no inflamables en condiciones normales. Antiguamente se les asignaba el grupo 0 de la tabla periódica porque se creía que tenían una valencia cero, es decir, que sus átomos no se pueden combinar con otros elementos para formar compuestos. Sin embargo, más tarde se descubrió que algunos sí forman compuestos, haciendo que se abandonara esta denominación.
Se conoce muy poco sobre las propiedades del miembro más reciente del grupo 18, el ununoctio (Uuo).
Los gases nobles tienen capas llenas de electrones de valencia. Los electrones de valencia son los electrones que se encuentran más al exterior de los átomos y normalmente son los únicos que participan en los enlaces químicos. Los átomos con capas de valencia llenas de electrones son extremadamente estables y por tanto no tienden a formar enlaces químicos y tienen poca tendencia a ganar o perder electrones.Sin embargo, los gases nobles más pesados, como el radón, están unidos menos firmemente por la fuerza electromagnética que los más ligeros, como el helio, haciendo que sea más fácil retirar electrones exteriores de los gases nobles pesados. Debido a que dicha capa está completa, los gases nobles se pueden utilizar de acuerdo con la notación de configuración electrónica para dar lugar a una "notación de gases nobles". Para ello, primero se escribe el gas noble más cercano que precede al elemento en cuestión, y se continúa la configuración electrónica a partir de ese punto. Por ejemplo, la notación electrónica del carbono es 1s2 2s2 2p2, y su notación de gas noble es [He] 2s2 2p2. Esta notación hace que resulte más fácil identificar elementos, y es más corta que escribir toda la notación de orbitales atómicos.
Usos
Hoy en día se utiliza helio líquido para refrigerar los imanes superconductores en los escáneres de resonancia magnética.Los gases nobles tienen un punto de ebullición y de fusión muy bajos, lo que los hace útiles como refrigerantes criogénicos.
En particular, el helio líquido, que hierve a 4,2 K, se utiliza para imanes superconductores, como los que se emplean para la imagen por resonancia magnética y la resonancia magnética nuclear.
El neón líquido, aunque no llega a temperaturas tan bajas como el helio líquido, también tiene aplicaciones en la criogenia, pues tiene una capacidad de refrigeración más de 40 veces superior a la del helio líquido y más de tres veces superior a la del hidrógeno líquido.
El helio se utiliza como componente de los gases respirables para sustituir al nitrógeno, gracias a su baja solubilidad en fluidos, especialmente en lípidos. Los gases son absorbidos por la sangre y los tejidos corporales cuando hay presión, como en el submarinismo, lo que provoca un efecto anestésico conocido como "mal de profundidad". Debido a su baja solubilidad, entra poco helio en las membranas celulares, y cuando se utiliza helio para sustituir parte de los gases respirables, como en el trimix o el heliox, se consigue una reducción del efecto narcótico del gas en profundidad. La baja solubilidad del helio ofrece más ventajas para el trastorno conocido como enfermedad por descompresión.
A menor cantidad de gas disuelto en el cuerpo significa que se forman menos burbujas de gas durante la reducción de la presión durante el ascenso. Otro gas noble, el argón, es considerado la mejor opción como gas de inflación del traje seco en el submarinismo.
Desde el desastre del Hindenburg de 1937,el helio ha sustituido al hidrógeno como gas de sustentación en los dirigibles y globos,gracias a su ligereza e incombustibilidad, pese a una reducción en la flotabilidad de un 8,6%.
En muchas aplicaciones, los gases nobles se utilizan para formar una atmósfera inerte. El argón se utiliza en la síntesis de compuestos sensibles al aire que al mismo tiempo, son sensibles al nitrógeno.
El argón sólido también se utiliza para estudiar compuestos muy estables, como intermedios reactivos, atrapándolos en una matriz inerte a temperaturas muy bajas.El helio es utilizado como medio portador en la cromatografía de gases, como gas de relleno en los termómetros, y en aparatos para medir la radiación, como el contador Geiger y la cámara de burbujas. Tanto el helio como el argón se utilizan habitualmente para proteger arcos de soldadura y metal base que les rodea de la atmósfera durante la soldadura y la ablación, así como en otros procesos metalúrgicos y la producción de silicio para la industria de los semiconductores.
Los gases nobles se usan habitualmente para la iluminación debido a su falta de reactividad química. El argón, mezclado con nitrógeno, se utiliza como gas de relleno de las bombillas incandescentes.
El kriptón se usa en bombillas de alto rendimiento, que tienen una temperatura de color más elevada y una mayor eficacia, pues reduce la velocidad de evaporación del filamento más que el argón, las lámparas de halógeno, en particular, utilizan kriptón mezclado con pequeñas cantidades de compuestos de yodo o bromo.Los gases nobles lucen con colores característicos cuando se les utiliza en lámparas de descarga, como los faros de neón, que producen un color naranja-rojo. El xenón es utilizado habitualmente en faros de xenón que, debido a su espectro casi continuo que se asemeja a la luz del día, se usan en proyectores de películas y como faros de automóvil.
Los gases nobles se usan en láseres de excímeros, que se basan en moléculas excitadas electrónicamente de vida corta conocidas como excímeros. Los excímeros utilizados en los láseres pueden ser dímeros de gases nobles como Ar 2, Kr 2 o Xe 2, o más habitualmente, el gas noble es combinado con un halógeno en excímeros como ArF, KrF, XeF o XeCl. Estos láseres producen una luz ultravioleta que, debido a su longitud de onda corta (193 nm por ArF y 248 nm para KrF), permite una imagen de alta precisión. Los láseres de excímeros tienen muchos usos industriales, médicos y científicos. Se utilizan en la microlitografía y la microfabricación, esenciales para la manufactura de circuitos integrados y por cirugía láser, incluyendo la angioplastia láser y la cirugía ocular.
Algunos gases nobles tienen un uso directo en la medicina. A veces se usa el helio para mejorar la facilidad de respiración de los pacientes con asma.
El xenón se utiliza como anestésico debido a su alta solubilidad en lípidos, que lo hace más potente que el habitual óxido nitroso, y como es eliminado fácilmente por el cuerpo, permite un restablecimiento más rápido.
La captación de imágenes hechas a través de la resonancia magnética utiliza el xenón en combinación con otros gases. El radón, que es muy radiactivo y sólo está disponible en cantidad mínimas, sirve en el tratamiento por radioterapia.
Gases finales
Si se quiere afinar más o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal habrá que recurrir a las ecuaciones de los gases reales que son variadas y más complicadas cuanto más precisas.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus átomos/moléculas se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals.
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad, tendencia a formar enlaces. Así, por ejemplo, los gases nobles al ser monoatómicos y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos como el dióxido de carbono, el caso del vapor de agua aún es peor ya que la molécula al ser polar tiende a establecer puentes de hidrógeno lo que aún reduce más la idealidad. Dentro de los gases orgánicos el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es porque cuanto más grande es la partícula fundamental constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros.
También se pierde la idealidad en condiciones extremas, altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus átomos/moléculas se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van der Waals.
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad, tendencia a formar enlaces. Así, por ejemplo, los gases nobles al ser monoatómicos y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos como el dióxido de carbono, el caso del vapor de agua aún es peor ya que la molécula al ser polar tiende a establecer puentes de hidrógeno lo que aún reduce más la idealidad. Dentro de los gases orgánicos el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es porque cuanto más grande es la partícula fundamental constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros.
También se pierde la idealidad en condiciones extremas, altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química.
Comportamiento de los gases
Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión, volumen, temperatura y masa de la muestra del material.
Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal.
Sus moléculas, en continuo movimiento, logran colisionar las paredes que los contiene y casi todo el tiempo ejercen una presión permanente. Como el gas se expande, la energía intermolecular (entre molécula y molécula) hace que un gas, al ir añadiéndole energía calorífica, tienda a aumentar su volumen.
Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir entre cada partícula se realiza mayor contacto, haciendo más fácil una o varias reacciones entre las sustancias.
Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
Un gas está constituido por moléculas de igual tamaño y masa, pero una mezcla de gases diferentes, no.
Se le supone con un número pequeño de moléculas, así su densidad es baja y su atracción molecular es nula.
El volumen que ocupa el gas es mínimo, en comparación con el volumen total del recipiente.
Las moléculas de un gas contenidas en un recipiente, se encuentran en constante movimiento, por lo que chocan, ya entre sí o contra las paredes del recipiente que las contiene.
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido.
Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y a la gran energía cinética de sus moléculas, las cuales se mueven.
Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal.
Sus moléculas, en continuo movimiento, logran colisionar las paredes que los contiene y casi todo el tiempo ejercen una presión permanente. Como el gas se expande, la energía intermolecular (entre molécula y molécula) hace que un gas, al ir añadiéndole energía calorífica, tienda a aumentar su volumen.
Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir entre cada partícula se realiza mayor contacto, haciendo más fácil una o varias reacciones entre las sustancias.
Para entender mejor el comportamiento de un gas siempre se realizan estudios con respecto al gas ideal aunque este en realidad nunca existe y las propiedades de este son:
Un gas está constituido por moléculas de igual tamaño y masa, pero una mezcla de gases diferentes, no.
Se le supone con un número pequeño de moléculas, así su densidad es baja y su atracción molecular es nula.
El volumen que ocupa el gas es mínimo, en comparación con el volumen total del recipiente.
Las moléculas de un gas contenidas en un recipiente, se encuentran en constante movimiento, por lo que chocan, ya entre sí o contra las paredes del recipiente que las contiene.
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido.
Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y a la gran energía cinética de sus moléculas, las cuales se mueven.
Suscribirse a:
Entradas (Atom)